
Inhoud
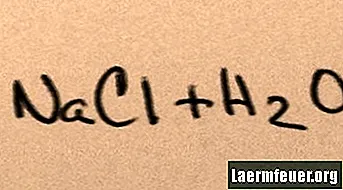
Wanneer zout aan water wordt toegevoegd, lost het op in zijn samenstellende moleculen totdat de maximale zoutionen die het water kan ondersteunen, rond de waterstof- en zuurstofmoleculen zweven. Wanneer dit gebeurt, wordt de oplossing "verzadigd" genoemd. Wanneer meer zout wordt opgelost, komen natrium- en chloride-ionen met elkaar in botsing en recombineren ze in zoutkristallen. Dit fenomeen staat bekend als "neerslag", omdat de gevormde vaste stof op de bodem van het water valt. Zouten zijn "hydrofiel", dat wil zeggen dat ze worden aangetrokken door water. Deze aantrekkingskracht maakt een bekende vorm van neerslag mogelijk: regendruppels vormen zich rond kleine zoutkristallen in de wolken, waardoor het een beetje zout smaakt.
De basis

Elektrolyten

Zout geleidt elektriciteit niet in vaste toestand, maar vormt in vloeibare (vloeibare) toestand een oplossing die elektriciteit zeer goed kan geleiden. Geleidbaarheid hangt af van het type zout dat wordt gebruikt, maar deze vloeistoffen, elektrolytoplossingen genoemd, zijn uitstekende dragers van verbindingen die het menselijk lichaam nodig heeft. De elektrische impulsen die door de hersenen worden gegenereerd, produceren vrije zuurstof, die door het bloed wordt gebruikt. De zoutmoleculen worden ingedeeld in elektrolyten (natrium, kalium of calcium) en chloriden in oplossing: het chloride wordt door het bloed en de nieren in de urine gepompt en de elektrolyten worden via het neuromusculaire systeem verdeeld in een proces dat atleten noemen rehydratie.
Colligatieve eigenschappen

Elke oplossing verschilt van de oorspronkelijke samenstelling omdat de toevoeging van moleculen, zelfs als ze geen nieuwe verbindingen vormen, het molecuulgewicht van de vloeistof verandert en de eigenschappen ervan beïnvloedt. Zout water is dichter dan zuiver water en bevriest ook langzamer. Terwijl het bevriest, migreert het zout echter naar de limieten van de vloeistof, waardoor het zwaarder en meer verzadigd wordt en vervolgens het vriespunt verlaagt. Aan de andere kant van de toestand van de materie, hoe dichter het zoute water, hoe meer warmte het nodig heeft om te verdampen, totdat het water wegloopt en een laag zout achterblijft. Koks wachten tot het water in de pan kookt om zout toe te voegen, om het verwarmen niet te vertragen. Deze eigenschappen, bekend als "colligatieve eigenschappen", helpen wetenschappers het molecuulgewicht van zout water te bepalen. Als de massa, de atmosferische druk en het kookpunt van de vloeistof kunnen worden gemeten, kunnen wetenschappers het molecuulgewicht van het water aftrekken om erachter te komen welke zouten aanwezig zijn.