
Inhoud
- functie
- structuur
- Het belang van catalase
- Factoren die de effectiviteit van catalase beïnvloeden
- Ander gebruik van catalase
Catalase is een enzym dat wordt aangetroffen in de cellen van dieren, planten en aerobe bacteriën. Een enzym is een groot molecuul, gesynthetiseerd in cellen en geproduceerd om te werken als een katalysator in een reactie. Elk type enzym heeft een specifieke functie en de functie van catalase is om een mogelijk schadelijk bijproduct om te zetten in elementen die nuttig zijn voor de cel.

functie
Catalase is, net als de meeste enzymen, een eiwit. Het wordt aangetroffen in de peroxisomen, membranous cell organelles. Catalase heeft een belangrijke biologische functie: het katalyseert de afbraak van waterstofperoxide, een stof die giftig is voor organismen, in water en moleculaire zuurstof, die zowel onschadelijk als nuttig zijn.

structuur
De halterstructuur van de catalase bevat vier polypeptideketens die elk meer dan 500 aminozuren bevatten. Catalase heeft ook vier heemgroepen, die zijn gemaakt van protoporfyrine-ringen, die een enkel ijzeratoom bevatten. Deze ringen zijn ondergebracht in de vier kettingen.
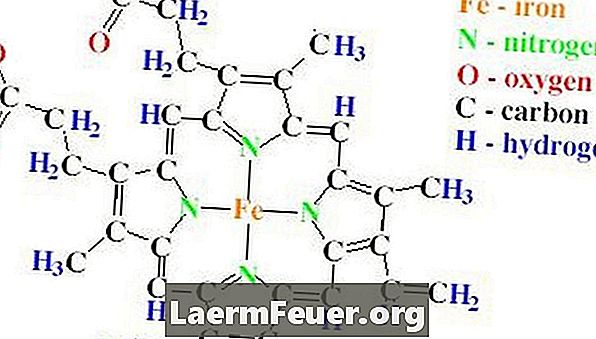
Het belang van catalase
Waterstofperoxide is een bijproduct van vele biologische functies van organismen. Alle aerobe organismen gebruiken zuurstof bij de ademhaling. De reductie van zuurstof in water is vaak onvolledig en er kan een extra elektron van een metaalion worden overgedragen, waardoor er peroxide ontstaat. Het meeste waterstofperoxide wordt echter gemaakt tijdens de productie van ATP in de mitochondriën. Hoewel waterstofperoxide giftig is voor levende cellen, vindt de reactie om het terug te breken in water en zuurstof snel en effectief plaats. Catalase staat bekend als een van de meest efficiënte enzymen, met een omzet van ongeveer 200.000 evenementen / seconde / subeenheid. Zonder katalase om de reactiesnelheid te verhogen, zou waterstofperoxide achterblijven en de cellen beschadigen.
Factoren die de effectiviteit van catalase beïnvloeden
Catalase en de activiteitsgraad ervan worden veranderd door verschillende factoren, waaronder temperatuur, pH, zoutconcentratie, hoeveelheid substraat en de aanwezigheid van remmers of activatoren. Temperatuur is een belangrijke factor in alle biochemische reacties, omdat hoge temperaturen de denaturatie van de enzymen kunnen veroorzaken. Wanneer het enzym wordt gedenatureerd, verandert het zijn conformatie, waardoor het substraat minder efficiënt bindt, waardoor de reactiesnelheid wordt verlaagd. Aan de andere kant, totdat de maximale temperatuur (die verschillend is voor elk type katalase) wordt bereikt, zal de reactiesnelheid toenemen samen met de temperatuur. De pH, de maat van de zuurgraad of de concentratie van waterstofionen in een oplossing, wordt gemeten op een schaal van 0 tot 14. Naarmate de oplossing zuurder wordt (minder dan 7), kan het enzym een waterstofion winnen uit de oplossing en naarmate de oplossing basischer wordt (boven de 7), kan er een waterstofion verloren gaan. Elk van deze uitersten kan de reactiesnelheid verlagen, omdat catalase-chemische bindingen veranderen. Er zijn twee soorten remmers: niet-competitieve remmers, die binden aan een site die niet de actieve site is, en competitieve remmers, die binden aan de actieve site van catalase. Kopersulfaat is een bekende niet-competitieve remmer van catalase en cyanide staat bekend als een competitieve remmer. In het algemeen zal, naarmate de hoeveelheid waterstofperoxide toeneemt, ook de reactiesnelheid toenemen. De enzymatische reacties volgen echter de Michaelis-Menten-vergelijking, die zegt dat elke reactie een verzadigingspunt zal bereiken, wat betekent dat bij een maximale reactiesnelheid, de toevoeging van meer substraat geen effect meer zal hebben.
Ander gebruik van catalase
Aangezien catalase aanwezig is in vrijwel alle levende organismen, is het een van de meest onderzochte enzymen. Dit leidde ertoe dat wetenschappers andere functies voor dit efficiënte enzym vonden. Catalase wordt gebruikt om de binnenkant van de plastics te behandelen om voedsel te verpakken. Het voorkomt oxidatie en helpt daardoor voedsel te besparen. Catalase wordt ook gebruikt tijdens het koude sterilisatieproces, dat een proces is voor het conserveren van melk en kaas door behandeling met waterstofperoxide. Dit enzym wordt gebruikt om resterende sporen waterstofperoxide te verwijderen.