Inhoud
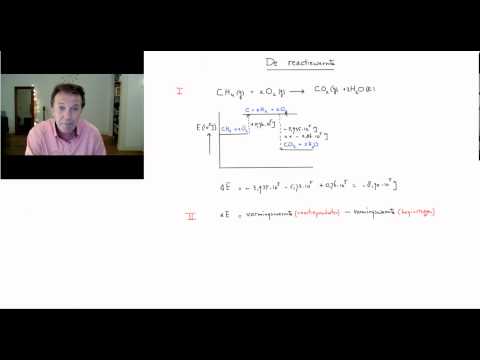
De warmte of enthalpie van een oplossing is de hoeveelheid warmte die wordt afgegeven of geabsorbeerd wanneer een stof wordt opgelost in een bepaald oplosmiddel (meestal water). Enthalpy is belangrijk omdat het bijdraagt aan de totale Gibbs-vrije energie en helpt om de oplosbaarheid van een verbinding te bepalen.

karakter
De beste manier om de warmte van een oplossing te bepalen, is door het in te denken als een hypothetisch proces in twee stappen waarbij de ionen worden gescheiden om een kristal en vervolgens een gas te vormen en ze vervolgens in water onderdompelen. Hoewel dit niet precies is wat er gebeurt, zal de enthalpie-verandering hetzelfde zijn, omdat de hitte van de reactie een toestandsfunctie is.
functie
De hoeveelheid warmte die nodig is om de ionische verbinding in gasvormige damp om te zetten is gelijk aan de verstrengeling die op zijn beurt equivalent is aan de sommatie van de enthalpie van formatie, de enthalpie van verstuiving en de ionisatie voor de elementen in de ionische verbinding. Door reticulaire enthalpie aan de enthalpie van hydratatie toe te voegen, wat de warmte is die vrijkomt wanneer de gasvormige ionen in het water worden ondergedompeld, is het mogelijk om de enthalpie of totale warmte van de oplossing te vinden.
nieuwsgierigheid
Het verbreken van links besteedt energie, terwijl ze zich vormen, releases. Dan, wanneer een ionische verbinding wordt opgelost in water, neemt het energie op om de ionen te verbreken, maar maakt het vervolgens vrij door de ion-dipoolbindingen te vormen met water. Dat is de reden waarom de som van de enthalpie van hydratatie en de enthalpie van verknoping gelijk is aan de warmte van de oplossing. Het is interessant om op te merken dat het zout (natriumchloride) eigenlijk een positieve enthalpie van de oplossing heeft, wat betekent dat het een kleine hoeveelheid warmte absorbeert wanneer het oplost. Omdat de entropietoename groter is dan de geabsorbeerde energie, kan het zout spontaan in het water oplossen.