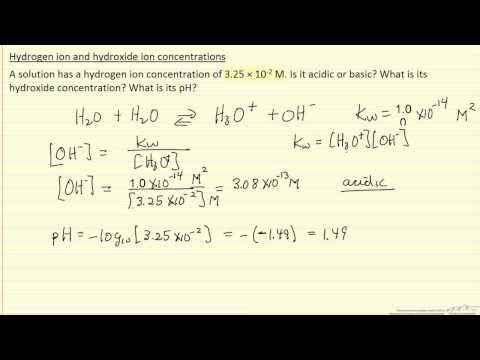
Inhoud

Wanneer een zuur of base wordt opgelost in water, valt het uiteen in ionen. Zuren geven waterstofionen af aan water en vormen daarbij hydroniumionen (H3O +). Basen vormen hydroxide-ionen (OH-). De pH van de oplossing meet het aantal opgeloste waterstof- en hydroxide-ionen. De pH-schaal varieert tussen nul en 14 en is logaritmisch, wat betekent dat elke verandering in pH overeenkomt met een tienvoudige verandering in ionconcentratie.
Stap 1
Vermenigvuldig de pH van de oplossing met -1. Als de oplossing bijvoorbeeld een pH heeft van 10,14: 10,14 × (-1) = -10,14.
Stap 2
Verhoog de waarde naar de tiende macht: 10 ^ (-10,14) = 7,244 × 10 ^ (- 11). Dit is de concentratie waterstofionen in de oplossing in mol per liter.
Stap 3
Tel 14 op bij het antwoord in stap 1:14+ (-10,14) = 3,86. Dit is de pOH-waarde van de oplossing.
Stap 4
Vermenigvuldig de pOH met -1: 3,86 × (-1) = -3,86.
Stap 5
Verhoog de gevonden waarde tot de tiende macht: 10 ^ (- 3,86) = 1,38 × 10 ^ (- 4). Dit is de concentratie van hydroxide-ionen in de oplossing in mol per liter.