Inhoud
Als u azijn (dat ethaanzuur bevat) en natriumbicarbonaat, dat een basis is, heeft gemengd, hebt u al een zuurbaseutralisatiereactie gezien. Als zuiveringszout en azijn, wanneer zwavelzuur wordt gemengd met een basis, zullen de twee neutraliseren. Dit soort reactie wordt chemisch neutralisatie genoemd.

karakter
Chemici definiëren zuren en basen op drie verschillende manieren, maar de meest bruikbare en bekende definitie beschrijft een zuur als een stof die waterstofionen afgeeft terwijl de base ze ontvangt. sterke zuren zijn beter voor het doneren van ionen, en zwavelzuur is absoluut een sterk zuur. Dus wanneer het in het water wordt gestoken, krijgt het bijna de deprotate vorm - in de praktijk schonken alle zuurmoleculen hun twee waterstofionen. Gedoneerde ionen worden gevangen door watermoleculen, die, wanneer ze worden geladen, hydroniummoleculen worden. De formule voor een hydronium-ion is H30 +.
reactie
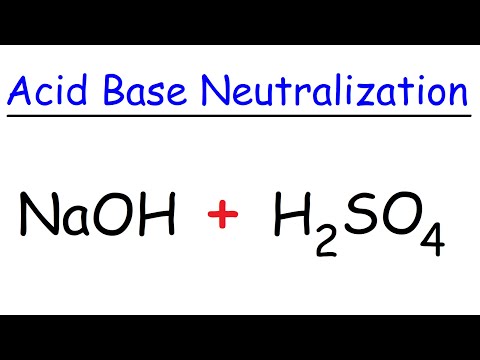
Wanneer de base of alkalische oplossing wordt toegevoegd aan het zwavelzuur, reageren en neutraliseren beide. De basis verwijdert waterstofatomen van de geladen watermoleculen, waardoor een hoge concentratie hydroxide-ionen vrijkomt. Deze reageren, naast het hydronium, om meer moleculen water en zout te vormen (het product van een zuur-base reactie). Omdat zwavelzuur sterk is, kan een van de twee dingen gebeuren. Als de base ook sterk is, zoals kaliumhydroxide, zal het resulterende zout (bijvoorbeeld kaliumsulfaat) neutraal zijn.Met andere woorden, noch zuur noch basisch. Aan de andere kant, als de base zwak is, zoals ammonia, zal het resulterende zout zuur zijn, dat werkt als een zwak zuur (bijvoorbeeld ammoniumsulfaat). Het is belangrijk op te merken dat, aangezien het zout twee waterstofionen heeft die kunnen worden gedoneerd, één molecuul zwavelzuur twee moleculen van een base zoals natriumhydroxide kan neutraliseren.
Zwavelzuur en natriumbicarbonaat
Aangezien natriumbicarbonaat vaak wordt gebruikt om zure lozingen van batterijen en in laboratoria te neutraliseren, is de reactie van zwavelzuur met bicarbonaat een bekend voorbeeld dat een kleine tegenvaller oplevert. Wanneer het bicarbonaat in contact komt met de zwavelzuuroplossing, accepteert het de waterstofionen om koolzuur te vormen, dat kan ontleden om water en kooldioxide af te geven. Als zwavelzuur en bicarbonaat reageren, bouwt de concentratie van koolzuur snel op, waardoor de vorming van kooldioxide wordt bevorderd. Een kokende massa van bellen vormt zich, terwijl koolstofdioxide uit de oplossing ontsnapt. Deze reactie is een eenvoudige illustratie van Le Chatellier's principe - wanneer veranderingen in concentraties een dynamisch evenwicht veranderen, reageert het systeem om een dergelijk evenwicht te herstellen.
Andere voorbeelden
De reactie tussen zwavelzuur en calciumcarbonaat is enigszins vergelijkbaar met de reactie met bicarbonaat - het koolstofdioxide komt uit als bellen en het zout dat wordt gegenereerd is calciumsulfaat. Reactie van zwavelzuur met een sterke base, zoals natriumhydroxide, zal natriumsulfaat produceren, terwijl zwavelzuur gereageerd met koperoxide de blauwe verbinding genaamd koper (II) sulfaat zal vormen. Zwavelzuur is zo sterk dat het zelfs kan worden gebruikt om een waterstofion in salpeterzuur te plaatsen, waardoor het nitronium-ion wordt gevormd. Deze reactie wordt gebruikt bij de productie van een van de beroemdste explosieven ter wereld: Trinitrotoluene of TNT.