Inhoud

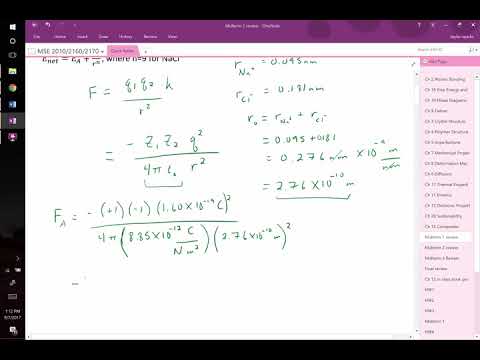
Wanneer metalen en ametalen verbindingen vormen, doneren de metaalatomen elektronen aan de ametaalatomen. Metaalatomen nemen dan positieve ladingen aan vanwege het verlies van elektronen, terwijl ametalen negatieve ladingen aannemen. Chemici noemen geladen atomen "ionen". Ionen vertonen een aantrekkingskracht voor ionen met een tegengestelde lading - vandaar het spreekwoord dat 'tegenpolen aantrekken' - de aantrekkingskracht tussen ionen met een tegengestelde lading, of afstoting tussen ionen met een gelijke lading, volgt de wet van Coulomb, wiskundig uitgedrukt aangezien F = k * q1 * q2 / d ^ 2, waarbij 'F' de aantrekkingskracht in newtons vertegenwoordigt, 'q1' en 'q2' de ladingen van de twee ionen in coulomb vertegenwoordigen, 'd' de afstand vertegenwoordigt tussen de ionkernen en "k" is de evenredigheidsconstante, die gelijk is aan 8,99 x 10 ^ 9 newton x vierkante meter per coulomb in het kwadraat.
Stap 1
Zoek in de tabel naar de ladingen van de positieve en negatieve ionen van de verbinding in kwestie. Volgens afspraak brengen chemische formules het positieve ion op de eerste plaats. In de verbinding calciumbromide of CaBr2 staat calcium bijvoorbeeld voor het positieve ion en heeft het een +2 lading, terwijl broom het negatieve ion voorstelt, met een -1 lading. Dus q1 = 2 en q2 = 1 in de vergelijking van de wet van Coulomb.
Stap 2
Zet de ionenladingen om in coulombs door elke lading te vermenigvuldigen met 1,9 x 10 ^ -19. Het +2 calcium zal dan een lading hebben van 2 * 1,9 x 10 ^ -19 = 3,8 x 10 ^ -19 coulombs, en broom zal een lading vertonen van 1,9 x 10 ^ -19 coulombs.
Stap 3
Bepaal de afstand tussen de ionen door ze te zoeken in de ionenstralentabel. Wanneer ionen vaste stoffen vormen, verschijnen ze meestal zo dicht mogelijk bij elkaar in de tabel. De afstand tussen hen wordt vervolgens bepaald door de straal van het positieve ion op te tellen bij de straal van het negatieve. In het calciumbromidevoorbeeld hebben Ca2 + -ionen een straal van ongeveer 1 Angstrom, terwijl Brionen een straal hebben die dicht bij 1,96 Angstrom ligt. De afstand tussen hun kernen is dan 1,00 + 1,96 = 3,96 Angstrom.
Stap 4
Zet de afstand tussen de ionenkernen om in metrische eenheden, vermenigvuldig de waarde in Angstrom met 1 x 10 ^ -10. Als we het vorige voorbeeld voortzetten, wordt de afstand van 3,96 Angstrom omgezet in 3,96 x 10 ^ -10 meter.
Stap 5
Bereken de aantrekkingskracht volgens de formule F = k * q1 * q2 / d ^ 2. Als we de eerder verkregen waarden van calciumbromide gebruiken en 8,99 x 10 ^ 9 als de k-waarde gebruiken, hebben we F = (8,99 x 10 ^ 9) * (3,8 x 10 ^ -19) * (1,9 x 10 ^ -19) / (3,96 x 10 ^ -10) ^ 2. Volgens de regels van de wetenschappelijke volgorde van bewerkingen, moet eerst het kwadraat van de afstand worden berekend en vervolgens F = (8,99 x 10 ^ 9) * (3,8 x 10 ^ -19) * (1,9 x 10 ^ -19) / (1,57 x 10 ^ -19). Als we doorgaan met vermenigvuldigen en delen, komen we uit op F = 4,1 x 10 ^ -9 newton. Deze waarde vertegenwoordigt de aantrekkingskracht tussen de ionen.