
Inhoud
Natriumacetaattrihydraat is een gebruikelijke en goedkope verbinding die wordt gebruikt voor verschillende toepassingen in voedingsmiddelen, industrieën en laboratoria. Het wordt gebruikt bij het beitsen, bruinen, als buffer en als hoofdbestanddeel van elektrische kompressen. Natriumacetaat wordt bestudeerd voor gebruik in denitrificatie van afvalwater als een component van nematiciden.
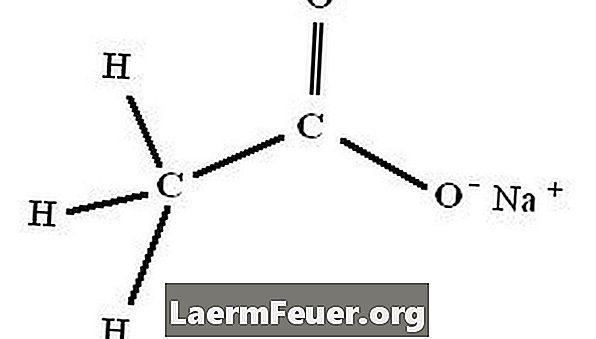
voorbereiding
Natriumacetaattrihydraat, chemische formule NaC2H3O2.3H2O, wordt onmiddellijk gevormd door de reactie tussen azijnzuur (azijn) en natriumhydroxide, natriumcarbonaat of natriumbicarbonaat.
Naam en formule
De wetenschappelijke naam voor azijnzuur is ethanoïsche alcohol. Om deze reden wordt natriumacetaat soms natriumethanoaat genoemd.
Organische chemicaliën schrijven de structuur van natriumacetaat als NaCl2H3O2.3H2O. In sommige situaties gebruiken ze echter de verkorte notatie "NaAc".
Gebruik van voedsel
In een één-op-één-verhouding kunnen natriumacetaat en azijnzuur worden gekristalliseerd in een product dat natriumdiacetaat wordt genoemd. Dit product is zeer nuttig in de voedingsmiddelenindustrie omdat het een vaste stof is met bijna geen geur, maar "in situ" het uiteenvalt in zijn componenten. Zowel natriumacetaat als diacetaat waren GRAS ("algemeen erkend als veilig") door de Food and Drug Administration.
Natriumacetaat wordt gebruikt in de vlees- en pluimvee-industrie om de smaak te verbeteren. Diacetaat wordt gebruikt voor een soortgelijk doel en als een groeiremmer van pathogenen.
Medisch gebruik
Natriumacetaat in de geneeskunde wordt gebruikt om elektrolyten te herstellen. Het dient ook als een diureticum.
De meest interessante toepassing ervan is in elektrische kompressen. Natriumacetaattrihydraat bevat drie kristallisatiemoleculen. Verwarm het tot 58 graden Fahrenheit en deze wateren zullen worden vrijgegeven van het kristal. Ze lossen het gedehydrateerde natriumacetaat op en vervangen de vaste stof door een oplossing. Deze oplossing kan zonder herkristallisatie tot kamertemperatuur worden gekoeld. Indien gewenst, met adequate stimulatie, kan deze vloeistof gedwongen worden om opnieuw te kristalliseren. De kristallisatie geeft warmte vrij door het gewenste lichaamsdeel te verwarmen.
Industrieel gebruik
Natriumacetaat is een alkalisch zout, het product van de reactie van een sterke base met een zwak zuur. Daarom maakt de basiciteit ervan, evenals de lage kosten ervan, het aantrekkelijk bij het neutraliseren van industriële minerale zuren van ontlading.
Bij ongediertebestrijding wordt natriumacetaat bestudeerd voor gebruik als een component van nematiciden. Nematoïden kunnen worden aangetrokken door natriumacetaat alsof het een aas is, net zoals insecten kunnen worden aangetrokken door feromonen.